用于組織重建的I型膠原支架通常具有受損的機(jī)械特性,例如剛度有限和缺乏強(qiáng)度。本研究提出了一種新技術(shù),通過用濃縮鹽溶液處理來微調(diào)膠原蛋白支架的剛度和生物降解性。膠原蛋白支架通過鑄造、冷凍和凍干過程制備。支架用90%飽和鹽溶液處理,鹽取自Hofmeister系列,然后進(jìn)行化學(xué)交聯(lián)。用由二價(jià)陽離子和一價(jià)陰離子組成的鹽處理,例如CaCl2,導(dǎo)致支架快速收縮至原始表面積的約 10%。有效鹽主要在霍夫邁斯特系列的離液末端。收縮的支架比不收縮的對照支架硬10倍以上,并且顯示出孔徑減小和腫脹,組織較少的膠原纖維。這種效應(yīng)可以精確到單個(gè)膠原蛋白分子的水平,并表明收縮效應(yīng)是由三螺旋內(nèi)穩(wěn)定氫鍵的破壞驅(qū)動的。鈣中無鈣沉積物2處理過的支架。與H相比,大鼠皮下植入顯示出相似的生物相容性2O和NaCl處理支架,但減少了細(xì)胞內(nèi)流并增加了結(jié)構(gòu)完整性,3個(gè)月后沒有顯著降解的跡象。綜上所述,高濃度離液鹽可用于調(diào)節(jié)膠原支架的力學(xué)特性,而不影響生物相容性。該技術(shù)可用于再生醫(yī)學(xué)中,以加強(qiáng)膠原蛋白支架以更好地順應(yīng)周圍組織,但也可用于例如緩釋藥物輸送系統(tǒng)。
氯化鈣的剛度2、氯化鈉和氫2用PIUMA納米壓頭測量O處理過的膠原蛋白支架(Optics11,荷蘭阿姆斯特丹;圖 3A)。16在測量之前,將支架在PBS中孵育30分鐘,然后在PBS中的60%牛血清白蛋白中進(jìn)行5分鐘的鈍化步驟,以防止探針粘附在支架上。每個(gè)樣品在25×1 mm的網(wǎng)格中進(jìn)行1個(gè)壓痕,單個(gè)壓痕之間的距離為200μm(圖3B)。對于軟樣品,壓頭探頭的剛度為 0.05 N m?1對于較硬的樣品,使用剛度為 0.47 N m 的探頭?1.兩個(gè)探頭的直徑均為180μm。壓痕深度,以 5 μm s 的速度達(dá)到?1,為15μm,探針保持在原位2秒(壓痕時(shí)間)。每種腳手架類型獨(dú)立測量3次。
使用納米壓痕評估剛度(圖3)。氯化鈣2、氯化鈉和氫2O處理過的支架獨(dú)立測量三次,每個(gè)支架在不同位置有25個(gè)壓痕(圖3B)。氯化鈣2腳手架 (7.4 × 103Pa)比NaCl更硬(1.2×103帕)和H2O 處理支架 (4.4 × 102Pa)如(圖3C)所示。峰值顯示剛度大于 3.0 × 104Pa,最有可能的是當(dāng)正好凹進(jìn)在多孔支架中的膠原蛋白結(jié)構(gòu)頂部時(shí),表明CaCl的剛度2處理過的膠原蛋白材料高于 7.4 × 103帕。



Piuma是功能強(qiáng)大的臺式儀器,可探索水凝膠、生理組織和生物工程材料的微觀機(jī)械特性。表征尺度從宏觀直至細(xì)胞。專為分析測試軟材料而設(shè)計(jì),測量復(fù)雜和不規(guī)則材料在生理?xiàng)l件下的力學(xué)性能。杭州軒轅科技有限公司
● 內(nèi)置攝像鏡頭,方便實(shí)時(shí)觀察樣品臺
● 實(shí)時(shí)分析計(jì)算測量結(jié)果,原始數(shù)據(jù)并將以文本文件存儲,方便任何時(shí)候?qū)隓ataviewer軟件進(jìn)行復(fù)雜處理
● 探針經(jīng)過預(yù)先校準(zhǔn),即插即用。對于時(shí)間敏感的樣品確保了快速測量
● 光纖干涉MEMS技術(shù)能夠以無損的方式測量即使是最軟的材料,并保證分辨率。同時(shí)探針可以重復(fù)使用Piuma軒轅納米壓痕儀Piuma軒轅納米壓痕儀
| 模量測試范圍 | 5 Pa - 1 GPa |
| 探頭懸臂剛度 | 0.025 - 200 N/m |
| 探頭尺寸(半徑) | 3 - 250 μm |
| 最大壓痕深度 | 100 μm |
| 傳感器最大容量 | 200 |
| 測試環(huán)境 | air, liquid (buffer/medium) |
| 粗調(diào)行程 | X*Y:12×12 mm Z:12 mm |
加載模式 | Displacement / Load* / Indentation* |
| 測試類型 | 準(zhǔn)靜態(tài)(單點(diǎn),矩陣) 蠕變,應(yīng)力松弛 DMA動態(tài)掃描 (E', E'', tanδ) |
| 動態(tài)掃描頻率* | 0.1 - 10 Hz |
| 內(nèi)置擬合模型 | Young's Modulus (Hertz / Oliver-Pharr / JKR) |
| *為可選升級配置 | |
新型光纖干涉式懸臂梁探頭,利用干涉儀來監(jiān)測懸臂梁形變。
創(chuàng)新型光纖探頭,彌補(bǔ)了傳統(tǒng)納米壓痕儀無法測試軟物質(zhì)的問題,也解決了AFM在力學(xué)測試中的波動大,操作困難、制樣嚴(yán)苛等常見缺陷。
● 背景噪音低:激光干涉儀抗干擾強(qiáng)于AFM反射光路
● 制樣更簡單:對樣品的粗糙度寬容度高于AFM
● 剛度選擇更準(zhǔn)確:平行懸臂梁結(jié)構(gòu)有利于準(zhǔn)確判別壓痕深度與壓電陶瓷位移比例關(guān)系,便于選擇合適剛度探頭來保證彈性形變關(guān)系的穩(wěn)定性,進(jìn)而獲得重復(fù)率更高、準(zhǔn)確性更好的數(shù)據(jù)
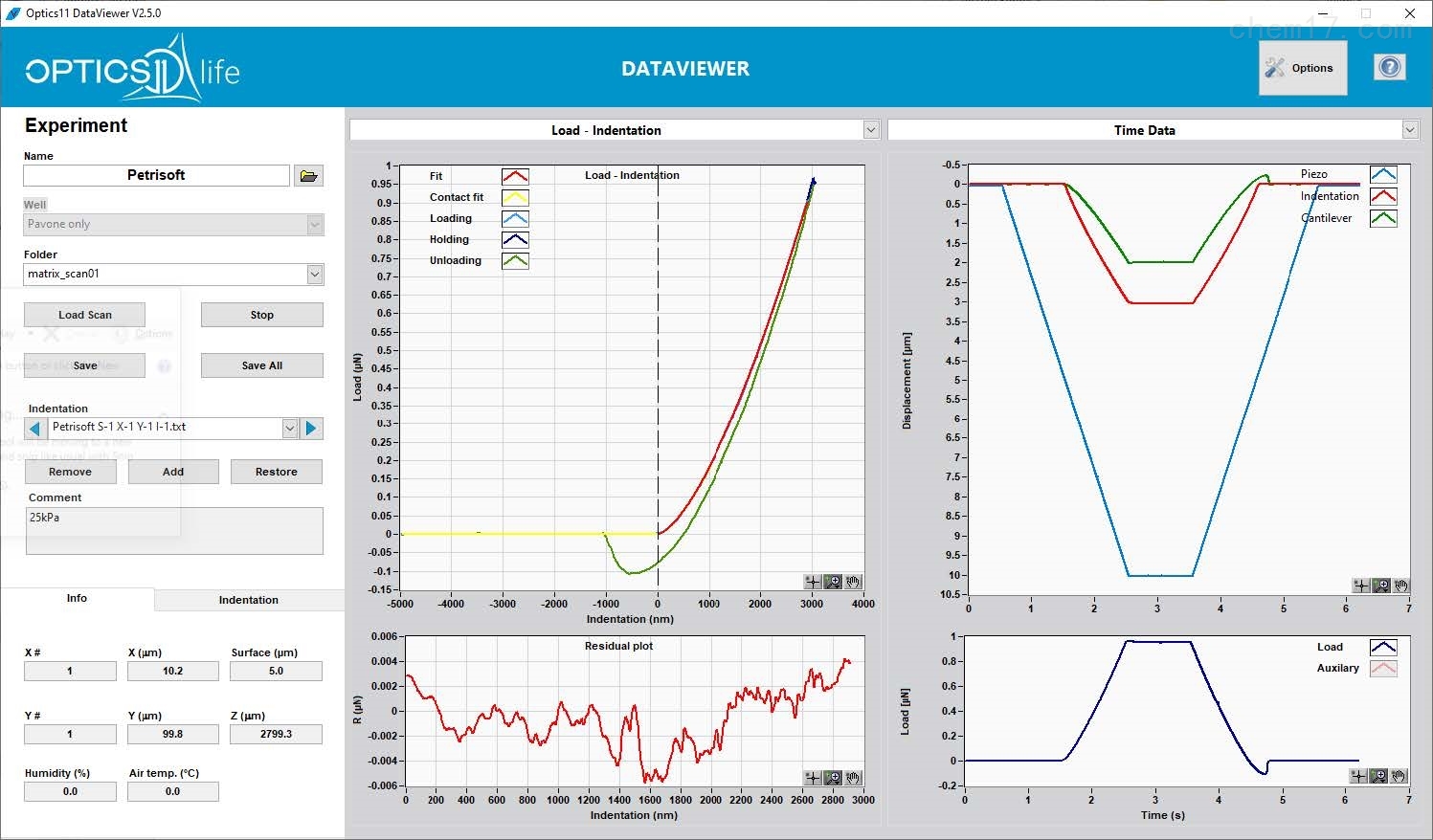
● 借助功能強(qiáng)大而易于操作的軟件,用戶可以自由控制壓痕程序(載荷、位移等)。自動處理曲線的流程,可以獲得數(shù)據(jù)和結(jié)果的快速分析
● 原始參數(shù)完整txt導(dǎo)出,便于后續(xù)復(fù)雜處理的需要
● 利用Hertz接觸模型從加載部分計(jì)算彈性模量,與常用的Oliver&Pharr方法相比,更為適合生物組織和軟物質(zhì)材料特性
| 年 份 | 期 刊 | 題 目 |
|---|---|---|
| 2022 | Advanced Functional Materials | Engineering Vascular Self-Assembly by Controlled 3D-Printed Cell Placement |
| 2022 | Biomaterials | Hydrogels derived from decellularized liver tissue support the growth and differentiation of cholangiocyte organoids |
| 2021 | Biofabrication | 3D bioprinting of tissue units with mesenchymal stem cells, retaining their proliferative and differentiating potential, in polyphosphate-containing bio-ink |
| 2021 | nature communications | Janus 3D printed dynamic scaffolds for nanovibration-driven bone regeneration |
| 2020 | Environmental Science & Technology | Effect of Nonphosphorus Corrosion Inhibitors on Biofilm Pore Structure and Mechanical Properties |
| 2020 | Acta Biomaterialia | A multilayer micromechanical elastic modulus measuring method in ex vivo human aneurysmal abdominal aortas |